FeyyazAdatepe
Misafir Editör
Bir kimyasal reaksiyon, bazı basamaklardan geçerek oluşuyorsa reaksiyonun hızı bu basamaklardan en yavaş olanın hızına eşit olacaktır. Bu en yavaş basamağa hız belirleyen basamak denir.
Bir reaksiyonun moleküleritesi, hız belirleyen basamakta rol alan moleküllerin yada iyonların sayısıdır.
Örnek
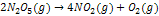
Deneyler bu reaksiyonun hızı için;
RH = k[N2O5] eşitliğini vermektedir.
2 mol N2O5 reaksiyona girdiği için reaksiyon basamağı ikidir.
Moleküleritesine göre;
Eğer bu tepkime reaksiyonun hız belirleyen basamağı ise moleküleritesi iki (bi-moleküler) oluyor.
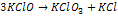
Deneyler bu reaksiyonun hızı için;
RH = k[KClO] 2 eşitliğini vermektedir.
Moleküleritesine göre;
Eğer bu tepkime reaksiyonun hız belirleyen basamağı ise moleküleritesi üç (tri-moleküler) oluyor.
Uni-moleküler bir reaksiyon I. basamaktan, bi-moleküler bir reaksiyon II. basamaktan, tri-moleküler bir reaksiyon ise III. basamaktan olmakla birlikte bu cümlelerin tersi doğru değildir.
Bir reaksiyonun moleküleritesi, hız belirleyen basamakta rol alan moleküllerin yada iyonların sayısıdır.
Örnek
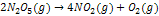
Deneyler bu reaksiyonun hızı için;
RH = k[N2O5] eşitliğini vermektedir.
2 mol N2O5 reaksiyona girdiği için reaksiyon basamağı ikidir.
Moleküleritesine göre;
Eğer bu tepkime reaksiyonun hız belirleyen basamağı ise moleküleritesi iki (bi-moleküler) oluyor.
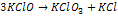
Deneyler bu reaksiyonun hızı için;
RH = k[KClO] 2 eşitliğini vermektedir.
Moleküleritesine göre;
Eğer bu tepkime reaksiyonun hız belirleyen basamağı ise moleküleritesi üç (tri-moleküler) oluyor.
Uni-moleküler bir reaksiyon I. basamaktan, bi-moleküler bir reaksiyon II. basamaktan, tri-moleküler bir reaksiyon ise III. basamaktan olmakla birlikte bu cümlelerin tersi doğru değildir.